Für die Qualität und Sicherheit von In-vitro-Medizinprodukten hat die EU mit der IVDR (In-vitro-Diagnostika Verordnung) einen neuen Rechtsrahmen geschaffen, der ab Mai 2022 für alle Mitgliedsstaaten rechtsverbindlich höhere Standards setzt. Die Verordnung verbessert vor allem die klinische Sicherheit von In-vitro-Diagnostika und bildet eine einheitliche Rechtsgrundlage für alle Hersteller.
Kernpunkte der Neuregelung sind verschärfte Anforderungen an Dokumentation, klinische Nachweise und Konformitätsbewertung sowie die Transparenz und Rückverfolgbarkeit nach Inverkehrbringen der Produkte. Hersteller zeigen mit der Zertifizierung, dass sie höchste Qualitäts- und Sicherheitsstandards erfüllen und über ein effektives Risikomanagement verfügen.
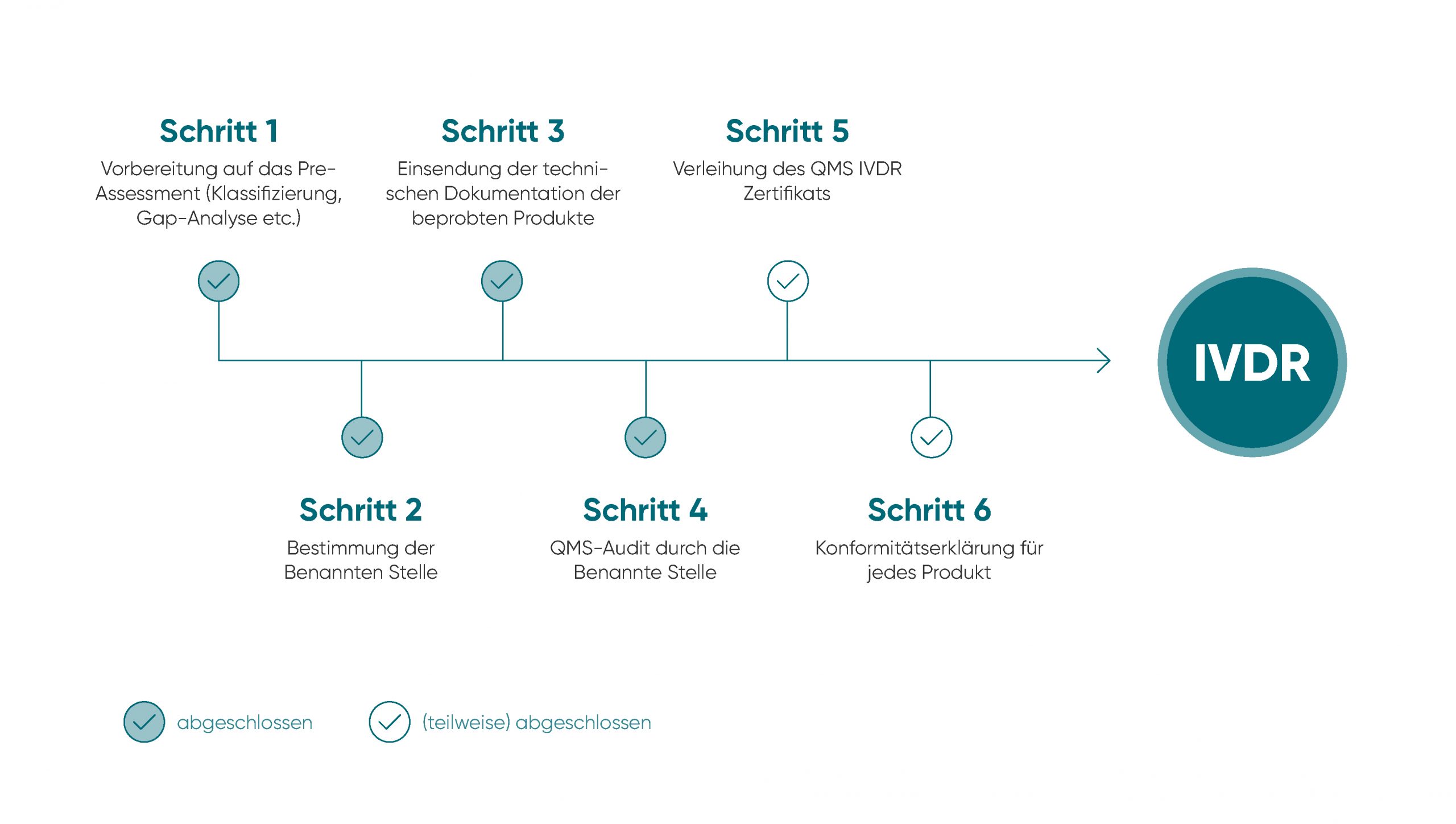
Mit seinem seit jeher hohen Qualitätsanspruch bekennt sich R-Biopharm zu 100 Prozent zu den IVDR-Bestimmungen und verfolgt unter Aufbringung erheblicher Ressourcen ihre vollständige Umsetzung. Mit unserem ganzheitlichen Qualitätsmanagementsystem sorgen wir dafür, dass von der Entwicklung bis zur Anwendung der Produkte die normativen und regulatorischen Anforderungen eingehalten werden und entsprechend hohe Qualitätsstandards gelten. Damit stellen wir sicher, Qualität kontinuierlich zu verbessern, um dauerhaft verlässliche und qualitativ hochwertige Produkte für die Gesundheit von Verbrauchern und Patienten zu liefern.
Mit seinem Zukunftswillen, der zu den Grundwerten des Unternehmens gehört, steht R-Biopharm zu diesem Bekenntnis. Zwar wurden die Übergangsfristen verlängert – Produkt-Innovationen müssen ab 26. Mai 2022 den neuen Regularien entsprechen, während das für Bestandsprodukte unterschiedlicher Klassen erst ab Ende Mai der Jahre 2025 (für Klasse-D-Produkte), 2026 (Klasse C) und 2027 (Klassen A Steril und B) gilt. Ungeachtet dieser Tatsache hat die Umsetzung der IVDR-Anforderungen weiterhin bei R-Biopharm höchste Priorität.