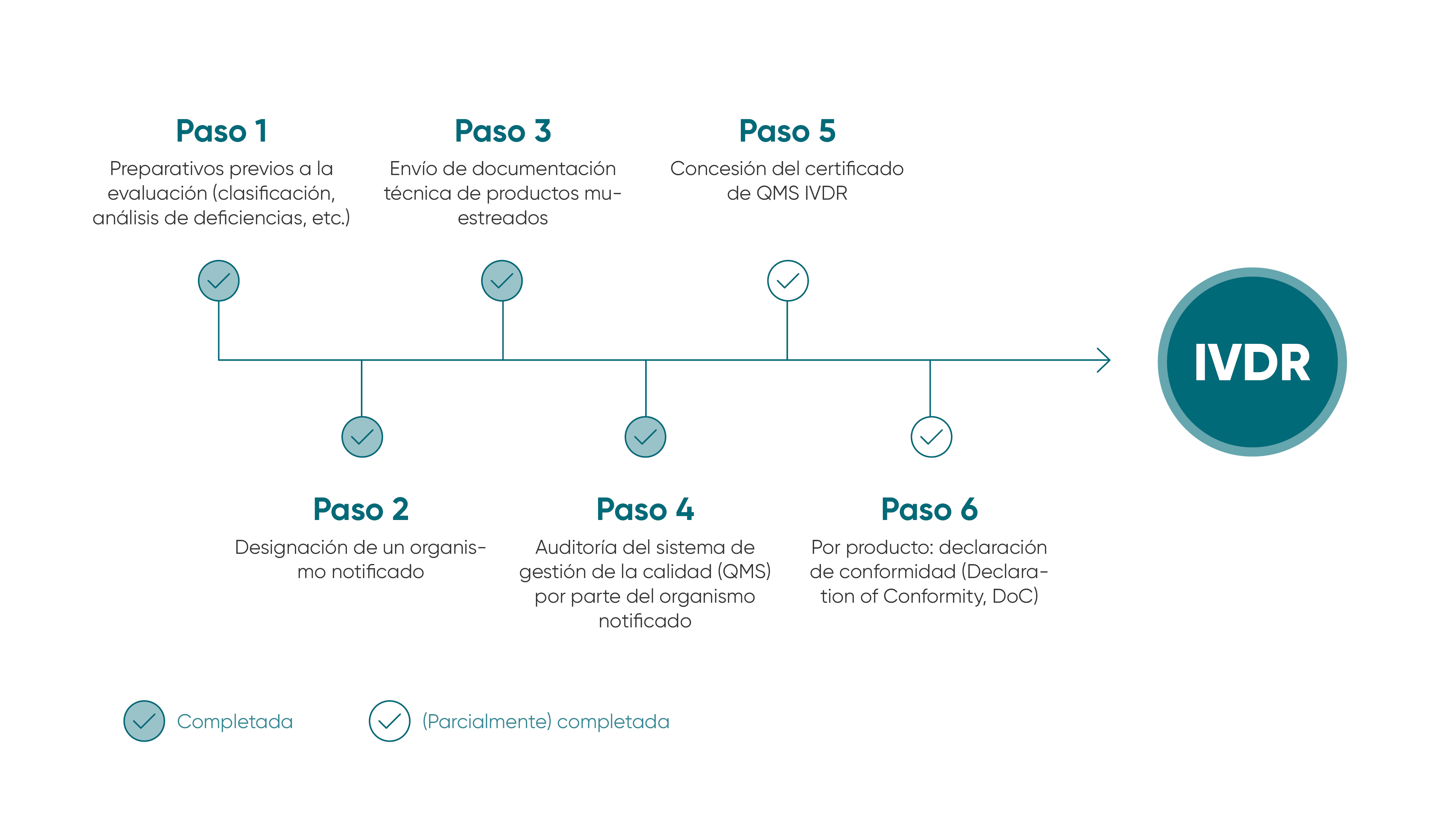
La UE ha creado un marco jurídico para la calidad y la seguridad de los dispositivos médicos in vitro, en concreto, el IVDR (Reglamento sobre los productos sanitarios para diagnóstico in vitro), que establece normas más estrictas y jurídicamente vinculantes para todos los Estados miembros de la UE a partir de mayo de 2022. En primer lugar, este decreto mejora la seguridad clínica de los dispositivos médicos de diagnóstico in vitro y establece una base jurídica uniforme para todos los fabricantes.
Los elementos clave del nuevo reglamento son requisitos más estrictos de documentación, pruebas clínicas y evaluación de conformidad, así como transparencia y trazabilidad una vez que los productos se lanzan al mercado. Con esta certificación, los fabricantes demuestran que cumplen con las mas estrictas normas de calidad y seguridad y que cuentan con un sistema de gestión de riesgos eficaz.
Puesto que siempre ha tenido un firme compromiso con la calidad, R-Biopharm afirma su garantía de cumplimiento al 100 % de las disposiciones del IVDR y emplea considerables recursos para vigilar la implementación completa de este reglamento. Nuestro exhaustivo sistema de gestión de la calidad nos permite garantizar el cumplimiento de las normas y los requisitos reglamentarios, así como la aplicación de normas de calidad con la exigencia adecuada para el desarrollo de productos de acuerdo con su uso. De esta manera garantizamos la mejora continua de la calidad con el fin de suministrar productos confiables y de alta calidad a largo plazo para la salud de los consumidores y pacientes.
R-Biopharm se mantendrá firme en su compromiso con la determinación de responder a los desafíos futuros, que es uno de los valores esenciales de nuestra empresa. Por supuesto, los periodos de transición se ampliaron; las innovaciones de productos deben cumplir con la nueva normativa a partir del 26 de mayo de 2022, mientras que para los productos existentes de distintas clases, esto solo se aplicará a partir de finales de mayo de 2025 (para productos de clase D), 2026 (clase C) y 2027 (clases A estéril y B). A pesar de este hecho, la implementación de los requisitos de IVDR sigue siendo la prioridad en R-Biopharm.