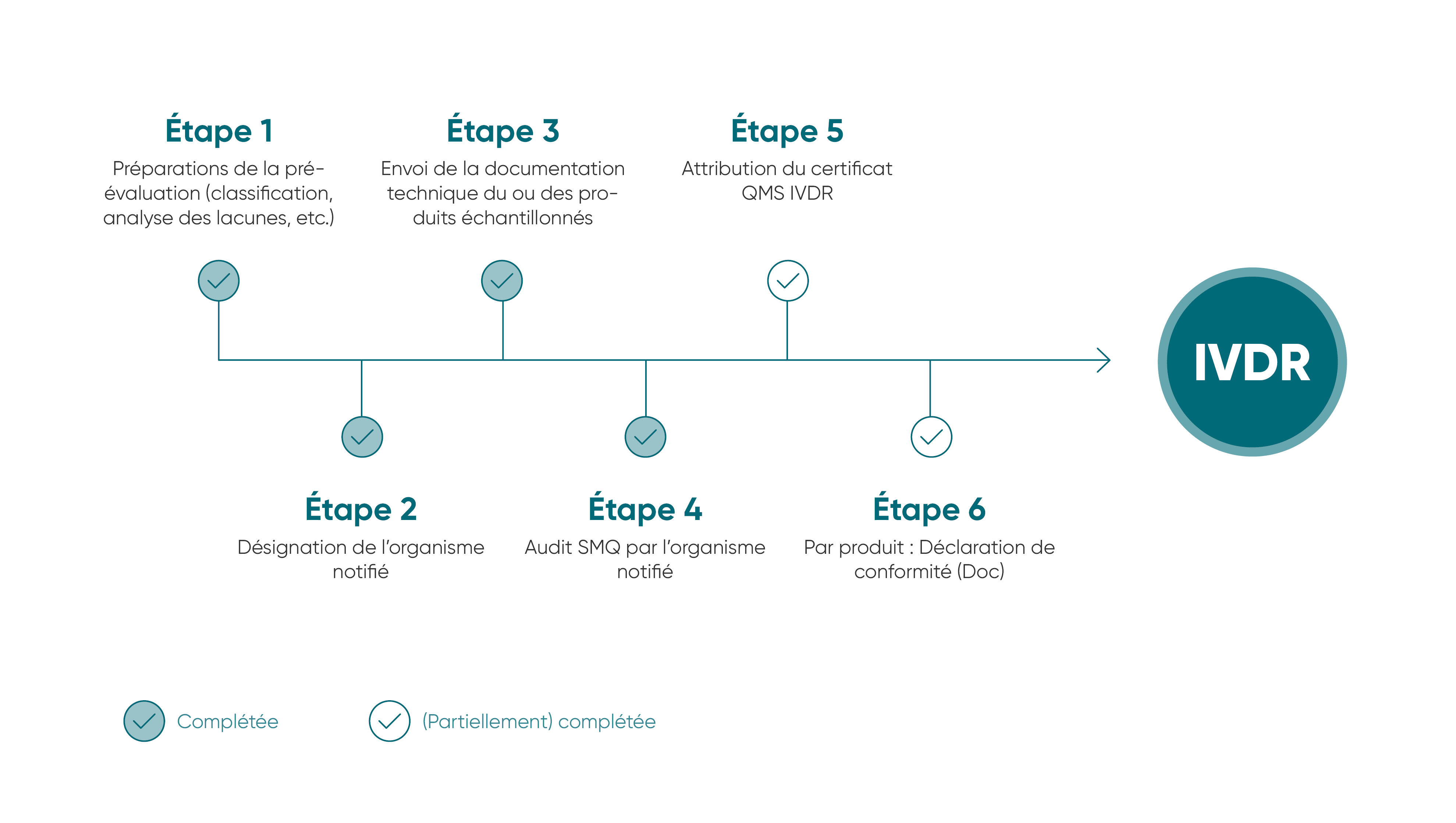
L’UE a créé un nouveau cadre juridique pour la qualité et la sécurité des dispositifs médicaux in vitro, à savoir l’IVDR (règlement relatif aux dispositifs médicaux de diagnostic in vitro), qui fixe des normes juridiquement contraignantes plus strictes pour tous les États membres de l’UE à partir de mai 2022. Avant tout, cette ordonnance améliore la sécurité clinique des dispositifs médicaux de diagnostic in vitro et établit une base juridique uniforme pour tous les fabricants.
Les éléments clés du nouveau règlement sont des exigences plus strictes en matière de documentation, de preuves cliniques et d’évaluation de la conformité, ainsi que la transparence et la traçabilité après la mise sur le marché des produits. Avec cette certification, les fabricants montrent qu’ils respectent les normes de qualité et de sécurité les plus exigeantes et qu’ils ont mis en place un système efficace de gestion des risques.
Étant donné que la qualité a toujours fait partie de ses engagements fermes, R-Biopharm affirme respecter à 100 % les dispositions de l’IVDR et emploie des moyens considérables pour surveiller la mise en œuvre intégrale de cette réglementation. Notre système complet de gestion de la qualité nous permet d’assurer le respect des normes et des exigences réglementaires, ainsi que l’application des normes de qualité appropriées, du développement des produits jusqu’à leur utilisation. De cette façon, nous garantissons une constante amélioration de la qualité afin de fournir des produits fiables et de grande qualité sur le long terme pour la santé des consommateurs et des patients.
R-Biopharm continuera à adopter un comportement ferme dans ce but avec la volonté de relever les défis futurs, l’une des valeurs fondamentales de notre entreprise. Bien sûr, les périodes de transition ont été prolongées – les innovations de produits doivent être conformes au nouveau règlement à partir du 26 mai 2022, même si pour les produits existants des différentes classes, cela ne s’appliquera qu’à partir de fin mai 2025 (pour les produits de classe D), 2026 (classe C) et 2027 (classes A-stérile et B). Malgré cela, la mise en œuvre des exigences de l’IVDR continue d’être une priorité absolue chez R-Biopharm.